Пост-релиз конференции «Полимеры в медицине 2018». Организатор – INVENTRA (в составе группы CREON).
Внутреннее производство медицинских изделий с 2015 г. увеличилось более чем на 15%. По оценкам Минпромторг России, отечественные производители занимают 18.5% рынка. Общепринятой мировой практикой можно считать долю импорта в 50-60%, и похожий ориентир (40% отечественной продукции к 2020 г.) заложен в стратегии развития отрасли. Российские производители медизделий из полимерных материалов в некоторых сегментах успешно конкурируют с импортом, но продукция более высокого класса все так же закупается за рубежом.
29 мая компания INVENTRA при поддержке выставки interplastica провела международную конференцию «Полимеры в медицине 2018». Генеральным информационным партнером стал журнал «Полимерные материалы».
«Медицина – стратегический вопрос, касающийся здоровья и качества жизни наших граждан. На сегодняшний день в России объем импорта медицинских изделий из полимерных материалов достаточно высок, но этот факт указывает на потенциал развития производства импортозамещающей отечественной продукции. В ходе мероприятия предлагаю выявить основные проблемы и определить наиболее эффективные механизмы, которые помогут в развитии данного сегмента в будущем», – отметил в приветственном слове генеральный директор INVENTRA Рафаэль Григорян.
Конференцию открыла начальник управления организации госконтроля и регистрации медицинских изделий Росздравнадзор Елена Астапенко, представив доклад о новеллах нормативно-правового регулирования в сфере обращения медизделий, результатах правоприменительной практики, которые дали возможность сделать отрасли шаг вперёд, и перспективах ее развития.
Начиная с 2012 г. принято более 20 нормативно-правовых актов, которые в т.ч. позволили упростить процедуру государственной регистрации для медизделий первого класса риска; запрашивать экспертным учреждениям у заявителя допматериалы и сведения для устранения несоответствий в регистрационных документах при проведении экспертизы качества, эффективности и безопасности; осуществлять консультирование по вопросам процедур, связанных с госрегистрацией медизделий; установить требования к технической и эксплуатационной документации; утвердить российскую номенклатурную классификацию медизделий по видам и сформировать подходы к регулированию цен на имплантируемые медицинские изделия в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
Выступающая добавила, что также подготовлены изменения, направленные на упрощение процедуры госрегистрации медизделий для in vitro диагностики; введены требования к внедрению, поддержанию и оценке системы менеджмента качества медизделий; разработана и внедрена система маркировки и идентификации, система реестров пациентов и имплантируемых медизделий; а также осуществлен переход к нормативно-правовому регулированию в рамках Евразийского Экономического Союза.
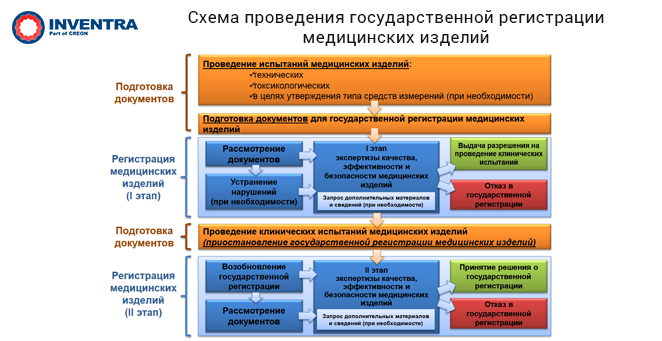
В 2017 г. Росздравнадзор в соответствии с п. 5.5(4) Положения о Федеральной службе по надзору в сфере здравоохранения, утвержденного постановлением Правительства РФ от 30.06.2004 №323, начал проводить работу по включению в единый реестр уполномоченных организаций, имеющих право проводить исследования (испытания) медицинских изделий в целях их регистрации в рамках ЕЭС.
На сегодняшний день в России девять уполномоченных организаций, проводящих технические испытания, включены в реестр, одна организация, проводящая исследования с целью оценки биологического действия, и две организации, проводящие клинические и клинико-лабораторные испытания.
Эксперт сообщила, что в рамках ЕЭС разработан порядок формирования перечня стандартов, в результате применения которого на добровольной основе обеспечивается соблюдение соответствия медизделий общим требованиям безопасности и эффективности, а также утвержден перечень соответствующих стандартов. Дополнительно Коллегией ЕЭК подготовлены проекты документов с критериями по включению в одно регистрационное удостоверение нескольких модификаций медизделия, разграничительного перечня и методические рекомендации по проведениям экспертизы безопасности, качества и эффективности регистрационного досье, по содержанию и структуре документов на него.
Юрист компании «САНА» Дмитрий Воевода спросил, может ли российская компания выступать уполномоченным представителем иностранной только по одному регистрационному удостоверению, и может ли уполномоченный представитель получить из Росздравнадзора комплект регистрационной документации? Г-жа Астапенко ответила, что российская компания может быть уполномоченным представителем иностранной по одному медицинскому изделию. Что касается второго вопроса – должно быть письмо от производителя о просьбе выдать комплект документации, а в случае зарубежного производителя – соответствующая доверенность о наделении полномочиями уполномоченного представителя по вопросам обращения медицинских изделий на территории РФ, и тогда Росздравнадзор предоставит необходимые документы.
Главный эксперт по продуктовому маркетингу ДБП «Сибур» Валерий Панарин добавил, что видит необходимость создания реестра одобренных для медицины сырьевых материалов, которые прошли необходимое тестирование и доказали свою безопасность, чтобы защитить граждан РФ от материалов, не соответствующих строгим медицинским стандартам.
Выступающая отметила, что Росздравнадзор совместно с Минпромторгом России рассматривает вопрос о создании реестра материалов, использующихся в медицинской промышленности, которые бы прошли все необходимые испытания, доказали свою безопасность и могли быть использованы на территории страны.
Помощник генерального директора «Долгопрудненского завода медицинских изделий» Юрий Двирняк уточнил, может ли компания зарегистрировать медизделие, используя в качестве доказательства его безопасности соответствие требованиям международных стандартов, не гармонизированных с российскими стандартами (отсутствие соответствующего стандарта ГОСТ Р ИСО)? Представитель Росздравнадзора сообщила, что в этом случае российская испытательная лаборатория не сможет провести испытания на данный стандарт. Однако, в соответствии с приказом Минздрава России от 19.01.2017 №11н, техническая документация должна содержать сведения о верификации и валидации медицинского изделия, которые использовались для доказательства соответствия установленным требованиям, в т.ч. результаты лабораторных и(или) заводских испытаний, включая результаты испытаний в условиях, имитирующих эксплуатационные. Таким образом, производитель вправе представить собственные испытания на данный стандарт, которые будут рассмотрены в рамках экспертизы качества, эффективности и безопасности медицинских изделий.
В продолжение разговора генеральный директор «Газстерил» Денис Мишин уточнил, что процесс стерилизации по документам Росздравнадзора носит формальный характер, единых требований по подготовке отчетов валидации нет, есть общий стандарт, но отсутствуют компании, которые имели бы области аккредитации в рамках данного стандарта и грамотных специалистов. Как, в таком случае, Росздравнадзор принимает документы с пометкой «отчет по валидации»? Выступающая согласилась, что вопрос стерилизации на территории России и организаций, которые ее осуществляют, сейчас стоит особенно остро, он болезненный. Добавив, что Росздравнадзор и Роспотребнадзор разрабатывают документ, в котором будут прописаны все требования.
Фонд Развития Промышленности на текущий момент профинансировал 254 проекта на общую сумму 60.3 млрд руб., из них на химическую отрасль пришлось 7.2 млрд руб., а на отрасль медбиофармы – 7.1 млрд руб., сообщил руководитель направления управления развития Государственной информационной системы промышленности Алексей Карапузов.
Также выступающий отметил, что в едином информационном пространстве ГИСП создается комплекс сервисов, учитывающий потребности пользователей всех уровней: предприятия и организации взаимодействуют с органами государственной власти на всех уровнях по вопросам промышленной политики. Особое внимание было уделено сервисам торговой площадки ГИСП, которая на сегодняшний день является одним из эффективных способов поддержки отечественного производителя. На текущий момент в торговую площадку ГИСП вовлечено более 1 млн участников кооперации, около 2 тыс. крупнейших заказчиков – госкорпораций и коммерческих компаний России. Объем торгов на площадке за 2017 г. составил 1.9 трлн руб.
ФРП совместно с компанией «ГЕКСА-нетканые материалы» запустили проект, направленный на создание и развитие комплексного современного автоматического производства одноразовых хирургических комплектов, одежды и белья из многослойных нетканых материалов собственного производства торговой марки Tutami.
Общий бюджет проекта, как сообщила директор департамента медицинских изделий компании «ГЕКСА-нетканые материалы» Любовь Чернова, составит около 768 млн руб., а доля финансирования ФРП – в размере 300 млн руб. Проект создан по программе импортозамещения как минимизация зависимости от импортного сырья, материалов и комплектующих.
В своем докладе о продуктовых решениях для медицины главный эксперт по продуктовому маркетингу дирекции базовых полимеров «Сибур» Валерий Панарин обратил особое внимание присутствующих на новую медицинскую марку полипропилена «Сибур» для выдувного формования PP R015 BM, предназначенную для производства флаконов для инфузионных растворов. Данная марка, по словам выступающего, полностью соответствует требованиям European Pharmacopoeia и способна заместить дорогостоящие импортные аналоги на рынке РФ.
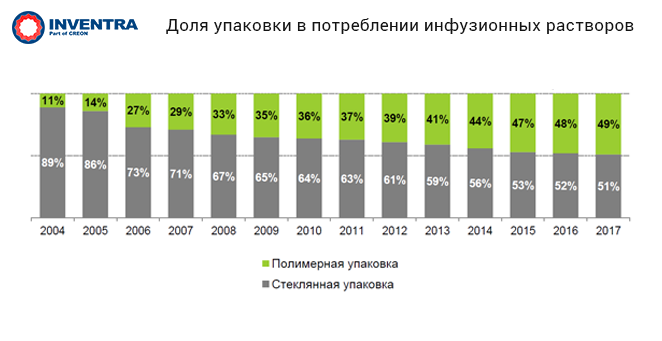
Полимерные флаконы все активнее вытесняют традиционные стеклянные при производстве инфузионных растворов. Так, в 2004 г. стеклянная тара составляла 89% от всего количества произведенных упаковок инфузионных растворов, а в 2017 г. её доля сократилась до 51%.
Также г-н Панарин отметил, что в России существуют избыточные мощности по производству инфузионных растворов. Ежегодно в РФ потребляется приблизительно 375 млн стандартных упаковок 500 мл инфузионных растворов (350 млн производится в РФ и 25 млн импортируется), в то время как отечественные производственные мощности составляют порядка 515 млн стандартных упаковок в год. Это приводит к обострению конкуренции среди производителей, успешными могут быть только те, которые выбирают наиболее современный и доступный материал для производства своих продуктов.
Главными преимуществами полимерной упаковки для инфузионных растворов эксперт назвал возможность производства на одной автоматической линии полностью готового продукта (технология Blow-Fill-Seal), высокое качество флаконов, существенно меньший вес, стойкость к механическим воздействиям, высокую степень защиты от подделок и абсолютную герметичность, которая обеспечивает высочайшую степень стерильности. Помимо прочего, полимерная упаковка дешевле и гораздо более удобна в обращении, чем традиционная стеклянная.
Говоря о сегменте литья под давлением, г-н Панарин представил специальные продуктовые решения для производства одноразовых медицинских шприцев, контейнеров для биоматериалов и прочих медицинских изделий, производимых методом литья полипропилена под давлением. Выступающий сообщил, что на литьевые высокоиндексные марки полипропилена PP H452 IM, PP H452 IM, PP H552 IM и PP H558 IM был получен Протокол токсикологических исследований, подтверждающих высокую чистоту данных марок. «Материал предназначен для изготовления изделий медицинского назначения, опосредованно контактирующих с внутренней средой организма и кровью, в т.ч. шприцев инъекционных однократного применения» - указано в протоколе.
Также г-н Панарин рассказал о новых проектах «Сибур» – логистическом хабе в Ворсино (старт в 2019 г.), который повысит доступность отечественных базовых полимеров для переработчиков и техническом центре развития переработки полиолефинов (старт в конце 2018 г.), нацеленном на изучение и повышение эффективности процессов переработки ПП и ПЭ.
Компания Solopharm производит 2.5 тыс инфузионных флаконов («Полифлак»), 20 тыс. юнидоз и ампул («Политвист»), 24 тыс. стеклянных ампул (CBR), 600 аэрозолей (BOV), 5 тыс. преднаполненных шприцев и картриджей, 10 тыс. мультидоз, 6 тыс. назальных спреев и 750 универсальных упаковок для медицинской продукции в час, об этом рассказал продакт менеджер «Гротекс» Олег Плаксин.
Главными преимуществами полимерной упаковки для стерильных растворов г-н Плаксин назвал удобное хранение и транспортировку, небольшую массу самой упаковки, высокую прочность при ударе, отсутствие риска травматизма и доступную цену. «Полифлак» – первые в России стерильные инфузионные растворы в ПП флаконах с удобной петлей для подвешивания, устойчивостью, градуировочной шкалой, самораспадающимся корпусом, дополнительным свободным объемом не менее 20% и двумя отдельными стерильными портами, закрытыми защитными полипропиленовыми пробками.
«Политвист», в свою очередь, выступающий назвал стерильными инъекционными растворами в ПЭ ампулах, среди главных преимуществ которых: простота и скорость использования, отсутствие необходимости применения дополнительной иглы, безопасность проведения инъекции для медицинского персонала и безопасность для пациента (исключена возможность попадания инородных тел).
Всего в 2017 г. в России было произведено 1.1 млрд одноразовых медицинских шприцев, их усредненная доля составила 42% от общего рынка, сообщил генеральный директор компании «Стерин» Юрий Желонкин. Г-н Желонкин отметил, что прошедший год показал относительную стабилизацию по ввозу шприцев, объемы импортных шприцев находились в пределах 55-61%, а среднегодовой показатель составил 58%, что на 3% ниже, чем в 2016 г.
Увеличение объемов поставок показал только Китай, и во втором квартале с.г. количество ввезенных китайских шприцев превысило количество немецкой продукции, ввоз которой наряду с испанской уменьшился. Но, несмотря на это, по году Германия занимает самую большую долю по поставке шприцев на российском рынке – 30%.
Среди основных проблем при производстве шприцев однократного применения выступающий выделил нехватку адаптированных и аттестованных марок. Производители, по словам г-на Желонкина, вынуждены использовать технические марки полимеров, изготовленные по пероксидной технологии, что запрещено в производстве медизделий в развитых странах.
«Рано или поздно эту задачу придется кому-то решать. Основное направление по контролю за производством, обращением и применениям медицинских изделий со стороны Росздравнадзора таково, что требования приближаются к европейским: и по применению стандартов ISO, и по требованиям при регистрации медизделий. Вообще, к Росздравнадзору сегодня масса вопросов. С точки зрения отечественных производств, есть некоторые упущения или поблажки импортерам, что делает их положение привилегированным. Например, при регистрации стерильного медизделия нужно обязательно предоставлять валидацию упаковки и стерилизации, но, вместе с тем, на рынке присутствует большая часть медизделий в упаковке «Полибэг», которая не может быть валидирована как упаковка для газовой стерилизации, т.к. она газонепроницаема», – резюмировал выступающий.
«В 2017 г. по инициативе руководителей шприцевых заводов в Росмедпроме провели совещание по вопросу применимости упаковки «Полибэг» при газовой стерилизации для шприцев и систем переливания крови, в которую упакованы изделия популярных европейских марок», – рассказал генеральный директор «Газстерил» Денис Мишин.
Лабораторные испытания показали, что более 30% закупленных в аптеках шприцев оказались нестерильными и токсичными, по системам переливания крови цифра еще больше – 70%.
«Специалисты уверены, что упаковка «Полибэг» не может быть применима для газовой стерилизации, потому что не пропускает стерилизационную смесь и рвется, но она дешевле, а потому наш рынок заполнен подобной продукцией и по сей день. К сожалению, действующая система мониторинга качества и безопасности обращаемых в продаже медизделий со стороны Роспотребнадзора и Росздравнадзора недостаточно эффективна. Официальная жизнь любого медицинского изделия начинается с регистрации в Росздравнадзоре, где с января 2015 г. при подаче досье на регистрацию обязательным пунктом добавлен «Отчет валидации процесса стерилизации медицинского изделия», но он негласно отнесен к формальному документу по принципу «должен быть». ISO-стандарт принят и введен в действие, а специалисты в регистрирующем органе не подготовлены. Потому и отсутствует общее понимание, что должен включать в себя отчет валидации. Ответ простой – требования к проведению этой процедуры, и, соответственно, отчету по ней, указаны в ISO-стандартах 11135 и 11137», – уточнил эксперт.
Валидация, по словам г-на Мишина, не творческий процесс, а четко определенная последовательная процедура с обязательным набором исследований и подтверждающих записей, которая не терпит вольных трактовок. Обязательным этапом газовой стерилизации является аэрация или дегазация медицинского изделия. Время и условия аэрации зависят от упаковки и вида медицинского изделия и необходимо учитывать его технические особенности, используемое сырье. При этом, стерилизационные циклы могут существенно отличаться друг от друга как по характеризации процесса, так и оборудования. Тесты на остаточное содержание этиленоксида проводятся на газовом хроматографе в процессе валидации медицинских изделий.
Выступающий утверждает, что валидация и стерилизация – сложные производственные процессы, затрагивающие все подразделения стерилизующей компании – и инженерную службу, и отдел качества, и лабораторию, и производство. Притом, многие производители прибегают к помощи консультантов, активно работающих на российском рынке и оказывающих услуги по оформлению ТУ, отчетов валидации и других документов для регистрации в Росздравнадзоре.
«Консультанты не проводят валидацию, а рисуют документы! Как уже сказано ранее – циклы стерилизации отличаются, но, главное, что в нарисованных отчетах нет фактических условий аэрации, и продукция гарантированно будет токсичной с существенным превышением уровня остаточного содержания этиленоксида. Соответственно, при проведении проверки Росздравнадзором на соответствие заявленных и фактических значений возникнут обоснованные претензии. Те же проблемы можно отнести и к радиационной стерилизации. Стерилизаторы и производители медизделий, зная, что лучи разрушают полимер, осознанно уменьшают дозу облучения в ущерб качеству стерилизации», – добавил г-н Мишин.
Проблем, по словам выступающего, еще много – неразвитые промышленные методы стерилизации, отсутствие госконтроля в этом процессе с учетом применяемого международного опыта систем GMP и ISO-стерилизации. Ситуация парадоксальная: все основные отрасли в стране имеют обязательную сертификацию по международным стандартам, а производство медизделий – только добровольную.
Получается, что одни собственники вкладывают сотни миллионов рублей в развитие производственных площадок стерилизации международного уровня, а рядом работают коллеги с минимальными инвестиционными затратами, покупая на рынке «древнее б/у» или китайское оборудование сомнительного качества. Кто в этой ситуации имеет конкурентные преимущества? Те, кто заботится о качестве или те, кто делает дешево?
В завершение выступления генеральный директор «Газстерил» отметил, что, несмотря на абсурдность происходящей ситуации, в нашей стране есть серьезные производители расходных материалов и медицинских изделий, которые заботятся о качестве собственной продукции и дорожат репутацией.
Валерий Панарин поинтересовался, где найти компании, которые делают радиационную стерилизацию? И как нужно правильно проводить такую процедуру? Г-н Мишин ответил, что в России появилась компания, проводящая такую стерилизацию – у них есть своя лаборатория и верное понимание значения валидации. По словам эксперта, нужно смотреть всю цепочку создания изделия, проверять и сырье, ведь очень важно, насколько чист сам продукт и насколько производственная зона соответствует уровню риска медицинского изделия, которое производится на той или иной территории. Продукт, безусловно, будет стерилен, но там останется большое количество мертвых клеток – это белок, а далее – онкология. Никто не задумывался, почему произошел «бум» этой болезни? Эксперт утверждает, что это связано в т.ч. и с тем, что люди используют стерильные, но одновременно «грязные» медизделия.
Также Денис Мишин попросил производителей пластиков провести исследования по воздействию газовой и радиационной стерилизаций на полимеры, наиболее используемые при производстве медицинских изделий отечественными производителями, в т.ч. по их токсичности после стерилизационной обработки, заверив, что все споры на этом закончатся.
Валерий Панарин поддержал предложение и отметил, что все стороны заинтересованы иметь проверенный, безопасный и стойкий к внешним воздействиям продукт, а также спросил, на что рассчитаны крупные центры стерилизации? Самое главное, по словам г-на Мишина, – кооперация: каким бы ни был крупным производитель, если он делает стерилизацию, соответствующую требованиям, стоимость проекта составит минимум €5 млн. То есть, если оборудование для производства одноразовых медизделий предположим до €2 млн, а годовая выручка планируется – 1 млрд руб., производителю необходимо вкладывать огромные средства в оборотный капитал и стимулировать продажи, поэтому ему и нужен сторонний сервис по стерилизации для минимизации затрат на инвестиционной фазе. «Мы и так работаем в условиях, где каждая копейка на счету. Для производителя важен регион присутствия стерилизации. Логистика – тоже важный фактор, но не ключевой. Конечно, если есть возможность минимизировать затраты производителю и обеспечить максимальный сервис стерилизации мирового уровня – это и есть наша работа и мы заинтересованы в развитии сети региональных стерилизационных центров», – подытожил генеральный директор «Газстерил».
Директор МИЦ «Композиты России» МГТУ им. Н.Э. Баумана Владимир Нелюб рассказал про новые технологии изготовления изделий из высокопрочных углепластиков с металлическим напылением и высокими деформационно-прочностными характеристиками. Проведенные в Центре исследования показали, что технологии напыления металлов на углеродное волокно позволяют улучшить характеристики материалов и изделий из них. В частности, речь шла о серебре – оно не только повышает адгезию, но и обладает антимикробными свойствами, как сообщил г-н Нелюб. Медицинские изделия из композитов, с нанесенным серебряным слоем, хорошо приживаются в организме человека и не позволяют микробам размножаться. Композиты с серебряным напылением ученые центра «Композиты России» планируют использовать для создания эндопротезов с целью замещения дефектов костей свода черепа, однополюсных тазобедренных суставов, ключиц, пластин для надкостного остеосинтеза и протезов.
Хотите читать новости первыми? Подписывайтесь на Telegram INVENTRA по ссылке https://t.me/inventra
Пост-релиз подготовила специалист по связям с общественностью INVENTRA Полина Андриянова




